
Opis svinčenega akumulatorja in teorija
Svinčevi akumulatorji se uporabljajo že skoraj 150 let, vendar za shranjevanje električne energije v akumulatorjih še vedno uporabljamo enak kemični princip, kot so ga uporabljali naši pradedje. Akumulatorji nam hranijo energijo, da jo imamo na razpolago takrat, ko jo potrebujemo. Če razumemo osnovni princip delovanja akumulatorjev, bomo lahko povečali njihovo učinkovitost in zanesljivost, ter zmanjšali možnost težav ali škode, ki lahko nastanejo zaradi nepravilne uporabe.
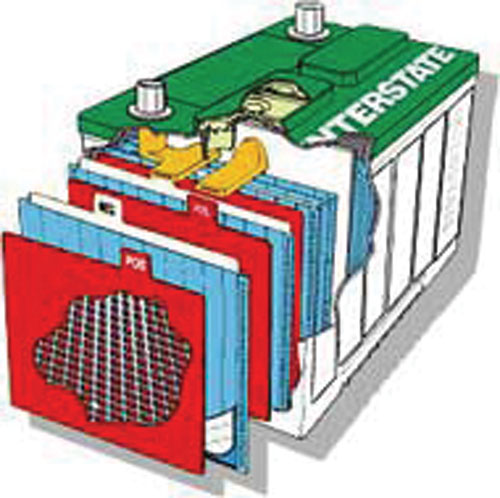
Celica svinčenega akumulatorja je sestavljena iz plošče svinca, plošče svinčevega oksida in izolacije med njima, vse skupaj pa je potopljeno v elektrolit, ki je raztopina 36% žveplene kisline in 64% vode. Ta raztopina se imenuje elektrolit zato, ker povzroča kemijsko reakcijo, ki proizvaja elektrone. Ko preizkušamo kakovost (specifično težo) elektrolita s hidrometrom, pravzaprav merimo količino žveplove kisline v elektrolitu. Če je nizka, to pomeni, da imamo primanjkljaj kemije, ki proizvaja elektrone.
Torej, kje je kemija? Počiva na svinčenih ploščah in ko spet napolnite baterijo, se žveplo vrne v elektrolit. Ko je celica akumulatorja napolnjena na 2,2 V, je akumulator napolnjen. Če poznamo temperaturo elektrolita, lahko z meritvijo napetosti na sponkah zelo točno ugotovimo procentualni nivo preostale akumulirane energije. Prav tako pa je temperatura pomembna pri polnjenju akumulatorja, saj smemo akumulator napolniti na dosti nižjo napetost, če je temperatura okolice višja. Na splošno velja, da vsaka napetost nad 2,15 V polni celico in če se držimo priporočenih vrednosti pri temperaturi okolice 20OC, je lahko najvišja napetost na celici med polnjenjem 2,415 V.
Elektronika za začetnike – Akumulatorji (1) 2009_SE167_35